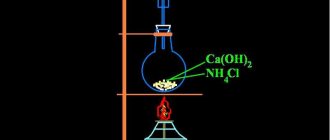
Гидроксид натрия имеет большое значение для промышленности, этим и обусловлено его широкое распространение. Каустик, или едкий натр, применяется практически во всех областях жизни человека — от химического производства до пищевой отрасли. Несмотря на свои разъедающие свойства, эта щелочь зарегистрирована как пищевая добавка Е524. Это не означает, что она вообще не несет вред для здоровья, хотя в минимальных дозах каустическая сода неопасна.
Гидроксид натрия крайне опасен в превышающих норму дозировках
История открытия вещества
Впервые упоминания о соединении, по свойствам напоминающем именно едкий натр, появляются еще в глубокой древности. Даже Библия содержит некоторые сведения о веществе neter, добываемом из египетских озер. Предположительно это и была каустическая сода.
Аристотелем, Платоном и другими древнегреческими и римскими философами и учеными также упоминается вещество nitrum, которое добывали из природных водоемов и продавали в виде больших разноокрашенных кусков (черных, серых, белых). Ведь о методах очистки тогда еще не знали ничего, поэтому отделить соединение от угля, загрязняющего его, возможности не было.
В 385 году до нашей эры нашло применение мыловарение. В основе процесса использовался едкий натр. Формула его, конечно, еще известна не была, однако это не мешало добывать его из золы растений рода Солянка, из озер и использовать для чистки бытовых предметов, стирки белья, изготовления различного мыла.
Чуть позже арабы научились добавлять в продукт эфирные масла, ароматические вещества. Тогда мыло стало красивым и приятно пахнущим. Начиналось активное развитие процессов и технологий мыловарения.
До самого XVII века едкий натр, свойства которого вовсю использовались, как химическое соединение оставался неизученным. Его объединяли с такими веществами, как сода, гидроксид калия, карбонаты калия, натрия. Все они носили название едких щелочей.
Позже ученый Дюамель дю Монсо сумел доказать различие этих веществ и разделил их на щелочи и соли. С тех пор едкий натр и получил свое истинное и постоянное до сегодняшнего дня имя.
Как можно использовать едкий натр в быту?
В домашних условиях каустическую соду обычно применяют для очистки посуды (кастрюль, сковородок и чайников) от нагара, застарелых пятен жира и накипи.
Также ее используют для прочистки канализационных стоков. Она разъедает все органическое, поэтому легко удаляет с поверхности труб все жировые, белковые и другие отложения.
Итак, для того чтобы избавиться от засоров в трубах вам нужно емкость, в которой хранится каустическая сода, хорошенько встряхнуть. Затем нужно налить или насыпать (в зависимости от того, в каком виде находится каустик: жидком или гранулообразном) 2-3 ложки вещества прямо в слив, а сверху нужно налить 1 стакан горячей воды. Необходимо выждать в течение двух часов, пока произойдет реакция, а после этого нужно промыть сток с помощью сильной струи воды.
Также едкий натр используют для очистки трубопроводов. Его добавляют в воду во время проверки труб с помощью ударной волны. Этот раствор помогает очистить их от ржавчины и накипи, образовавшейся на внутренней поверхности труб.
Синонимы названий
Следует отметить, что название этого вещества неодинаково и имеет несколько синонимов. Всего можно обозначить 6 разных вариантов:
- гидроксид натрия;
- натр едкий;
- сода каустическая;
- натриевая щелочь;
- каустик;
- едкая щелочь.
Каустической содой данное соединение называют в простонародье и промышленности. В химических синтезах более правильно говорить натриевая щелочь или едкий натр. Формула от этого не меняется. Самое обыденное название — каустик. Правильным с точки зрения систематической номенклатуры веществ является название гидроксид натрия.
Выгребные ямы
Каустическую соду относят к щадящим веществам для очистки выгребных ям, но ее применение возможно только при соблюдении всех условий:
- Септики должны быть герметичными, так как вещество, вступив в реакцию, может нанести вред грунту и окружающей среде.
- Во избежание взрывоопасной ситуации система вентиляции должна работать без перебоев.
- Нельзя начинать уборку без защитного костюма, перчаток, очков.
Сточные ямы очищают при помощи раствора едкой щёлочи.
Указанную в инструкцию порцию соды разводят в холодной воде, постоянно помешивая. На пике своей активности состав находится около четырёх минут, поэтому средство сразу же используют по назначению.
Химическая формула и строение молекулы
Если рассматривать данное вещество с точки зрения химии, то оно будет состоять из двух ионов: катиона натрия (Na+) и гидроксид-аниона (ОН-). Связываясь между собой за счет электростатического притяжения разнозаряженных частиц, данные ионы формируют едкий натр. Формула эмпирического вида будет NaOH.
Гидроксогруппа образована ковалентной полярной связью между кислородом и водородом, при этом с натрием она удерживается ионной связью. В растворе щелочь полностью диссоциирует на ионы, являясь сильным электролитом.
Физические характеристики каустической соды
Молекулярная масса: 39,997 г/моль
Температура кипения 44%-го раствора 140-142°С
Температура замерзания соды каустической жидкой, марки РД, 1 сорт, с концентрацией 44% равна +7°С. Зависимость точки замерзания каустической соды представлена на Рис. 1:
Плотность 44%-го раствора — 1,468 г/см3 . Плотности водных растворов каустической соды представлены на Рис.2:
Раствор каустической соды относится к сильным электролитам. Удельная электропроводность представлена на Рис.3:
Лабораторный способ получения
Промышленные и лабораторные способы получения едкого натра тесно перекликаются. Часто в малых количествах его получают химическими и электрохимическими методами в более маленьких установках, чем на промышленных объектах. А тонны вещества теми же способами производятся в огромных колоннах электролизерах.
Можно назвать несколько основных способов синтеза каустика в лаборатории.
- Ферритный способ. Состоит из двух основных этапов: на первом происходит спекание под действием высокой температуры карбоната натрия и оксида железа (III). В результате образуется феррит натрия (NaFeO2). На втором этапе он подвергается действию воды и разлагается с образованием гидроксида натрия и смеси железа с водой (Fe2O3*H2O). Полученный едкий натр из раствора выпаривают до кристаллов или хлопьев белого цвета. Его чистота составляет примерно 92%.
- Известковый способ. Заключается в реакции взаимодействия между карбонатом натрия и гидроксидом кальция (гашеной известью) с образованием карбоната кальция и каустика. Реакцию проводят при температуре 80оС. Так как образующаяся соль выпадает в осадок, то ее легко отделяют. Оставшийся раствор выпаривают и получают натриевую щелочь.
- Диафрагменный и мембранный способ получения. Основан на работе установки электролизера. В нее подается раствор соли поваренной (NaCL), который подвергается электролизу с образованием свободного газообразного хлора и нужного продукта каустика. Разница данных методов в том, что при диафрагменном способе главной структурной частью устройства является диафрагма из асбеста (катод). При мембранном способе катодное и анодное пространство разделено специальной мембраной.
Таким образом и получают в лаборатории гидроксид натрия, выбирая наиболее выгодный в материальном плане вариант. Он же, как правило, менее энергозатратный.
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
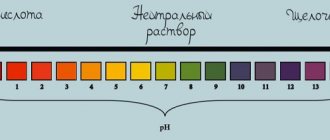
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O (t = 50-60 °C).
В результате реакции образуются сульфид натрия, сульфит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
В результате реакции образуются алюминат натрия, водород и оксид натрия.
4. реакция гидроксида натрия с алюминием и водой:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
5. реакция гидроксида натрия с цинком:
Zn + 2NaOH → Na2ZnO2 + H2 (t = 550 °C).
В результате реакции образуются цинкат натрия и водород.
6. реакция гидроксида натрия с цинком и водой:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
H3PO4 + NaOH → NaH2PO4 + H2O.
В результате реакции образуются дигидроортофосфат натрия и вода. При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
8. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
9. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
H2S + 2NaOH → Na2S + 2H2O,
H2S + NaOH → NaHS + H2O.
В результате реакции образуются в первом случае – сульфид натрия и вода, во втором – гидросульфид натрия и вода. При этом гидроксид натрия в первом случае в качестве исходного вещества используется в виде концентрированного раствора, во втором случае – в виде разбавленного раствора.
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
2HF + NaOH → NaHF2 + H2O.
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.
15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (t = 90 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Al2O3 + 2NaOH → 2NaAlO2 + H2O (t = 900-1100 °C).
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.
17. реакция гидроксида натрия с оксидом алюминия и водой:
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6],
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4].
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.
18. реакция гидроксида натрия с оксидом железа:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O (t = 600 °C, р).
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода (углекислым газом):
NaOH + CO2 → NaHCO3.
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
SO2 + NaOH → NaHSO3.
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
2NaOH + SiO2 → Na2SiO3 + H2O (t = 900-1000 °C),
4NaOH + SiO2 → Na4SiO4 + 2H2O.
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t = 1000 °C),
Al(OH)3 + NaOH → Na[Al(OH)4].
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Fe(OH)3 + 3NaOH ⇄ Na3[Fe(OH)6].
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (kat = N2).
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3.
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Синтез в промышленности
Как же получают в промышленности такое вещество, как натр едкий? Жидкий и твердый каустик добывается чаще всего электрохимическим способом. Он основан на электролизе раствора природного минерала галита, подавляющая часть которого сформирована поваренной солью.
Главная особенность такого синтеза в том, что побочными продуктами вместе с едким натром являются газообразные хлор и водород. Процесс осуществляется в любом из трех вариантов:
- электролиз диафрагменный на твердом катоде;
- с жидким катодом из ртути;
- мембранный с твердым катодом.
Подавляющее большинство производимого в мире каустика образуется все же по методу с мембраной. Полученная щелочь отличается достаточно высоким уровнем чистоты.
Области применения
Существует достаточно много отраслей, в которых актуален едкий натр. Применение основано на его химических и физических свойствах, делающих данное соединение незаменимым во многих синтезах и процессах.
Можно выделить несколько основных областей, в которых гидроксид натрия — обязательный элемент.
- Химическое производство (синтез сложных эфиров, мыла, жиров, получение волокон, травление алюминия, для получения продуктов нефтепереработки, как катализатор во многих процессах; является основным веществом для нейтрализации кислот и соответствующих им оксидов; в аналитической химии применяется для титрования; также используется для получения чистых металлов, многих солей, других оснований и органических соединений).
- При производстве бумаги для обработки целлюлозы древесины (избавления от древесного вещества лигнина).
- В хозяйственной деятельности человека также незаменим едкий натр. Применение многочисленных моющих и чистящих средств на его основе очень актуально. Мыловарение, получение шампуней — все это не обходится без каустической соды.
- Необходим для синтеза биотоплива.
- Применяется в государственных масштабах для дегазации и нейтрализации отравляющих веществ, воздействующих на организмы.
- Производство лекарств и наркотических средств.
- Пищевая отрасль — кондитерские изделия, шоколад, какао, мороженое, окрашивание конфет, маслин, выпечка хлебобулочных изделий.
- В косметологии для удаления инородных образований (родинки, папилломы, бородавки).
- Используется на ликеро-водочных и табачных комбинатах.
- В текстильной промышленности.
- Производство стекла: цветного, обычного, оптического и прочего.
Очевидно, что гидроксид натрия — очень важное и полезное в деятельности человека вещество. Совершенно не зря оно синтезируется в мире ежегодно в тоннах — 57 миллионов и более.
Химические показатели каустической соды (таблица 1)
| № п/п | Наименование показателей | Марка ТР | Марка РД | |
| Высший сорт | Первый сорт | |||
| 1 | Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Бесцветная или окрашенная жидкость, допускается выкристаллизованный осадок | |
| 2 | Массовая доля гидроксида натрия, %, не менее | 98,5 | 46,0 | 44,0 |
| 3 | Массовая доля углекислого натрия, %, не более | 0,8 | 0,6 | 0,8 |
| 4 | Массовая доля хлористого натрия, %, не более | 0,05 | 3,0 | 3,8 |
| 5 | Массовая доля железа в пересчете на Fe2O3, %, не более | 0,004 | 0,007 | 0,02 |
| 6 | Массовая доля хлорноватокислого натрия, %, не более | 0,01 | 0,25 | 0,3 |
| 7 | Массовая доля ртути, %, не более | 0,0005 | — | — |
Физические свойства
Белое порошкообразное вещество, иногда бесцветное. Может быть в виде мелкокристаллического порошка либо в виде хлопьев. Чаще в форме крупных кристаллов. Температура плавления достаточно низкая — 65,1оС. Очень быстро поглощает влагу и переходит в гидратированную форму NaOH·3,5Н2О. В этом случае температура плавления еще меньше, всего 15,5оС. Практически неограниченно растворяется в спиртах, воде. На ощупь как твердое вещество, так и жидкое мылкое.
Очень опасное в концентрированном и разбавленном виде. Способно повреждать все оболочки глаза, вплоть до зрительных нервов. Попадание в глаза может закончиться слепотой. Поэтому работа с данным соединением крайне опасна и требует защитных приспособлений.
Меры безопасности
Каустическая сода в чистом виде — это очень агрессивная щелочь, которая способна вызвать сильный химический ожог при попадании на кожу или в глаза. Поэтому если вы решите ее использовать дома, то обязательно позаботьтесь о мерах безопасности. Обычные кухонные перчатки не подойдут. Нужно использовать специальные прорезиненные перчатки, а также защитные очки.
Если вам в глаза случайно попал каустик, то их немедленно нужно промыть под струей воды, а после этого стоит обратиться к врачу. Если же он попал на кожу, то ее нужно протереть слабым раствором уксуса, чтобы нейтрализовать действие щелочи.
Храните каустическую соду в плотно закрытой емкости и в труднодоступных местах, чтобы дети не могли до нее добраться, и никогда не забывайте про средства защиты, когда используете ее в домашних условиях.
Facebook
Условия хранения
Хранение натра едкого осуществляется по определенным условиям. Это объясняется тем, что он крайне реакционноспособен, особенно, когда помещение влажное. Основными условиями можно назвать следующие.
- Хранение вдали от отопительных приборов.
- Герметично закрытые и запаянные упаковки, не способные пропускать влагу.
- Сухой кристаллический каустик хранится в мешках специального состава (плотный полиэтилен), жидкий — в темной стеклянной таре с притертыми пробками. Если же количество его большое и требует транспортировки, то раствор натра едкого помещают в специальные стальные контейнеры и канистры.
Перевозить данное вещество можно любым известным способом с соблюдением правил техники безопасности, исключая транспортировку по воздуху.
Жидкая натриевая щелочь
Помимо кристаллического, существует еще водный раствор едкого натра. Формула его та же, что и для твердого. В химическом отношении растворы более применимы и удобны в использовании. Поэтому в такой форме каустик используется чаще.
Раствор едкого натра, формула которого — NaOH, находит применение во всех вышеперечисленных областях. Он неудобен только при транспортировании, так как перевозить лучше сухой каустик. По всем остальным свойствам нисколько не уступает кристаллам, а в некоторых и превосходит их.
Как обработать ожог
Внимание! Если едкий натр попал в глаза, их необходимо промыть прохладной водой в течение нескольких минут.
Первая помощь при повреждении кожного покрова включает несколько пунктов:
- Смывание щёлочи. Процедуру необходимо проводить не менее 20 минут. Для очищения можно использовать только воду. Влажные салфетки или смоченное полотенце не подходят, так как они могут стать причиной более глубокого проникновения реагента в кожную структуру.
- Нейтрализация действия щёлочи. На этом этапе повреждённое место обрабатывают водным раствором уксуса или лимонного сока.
- Ослабление болевых ощущений. Для реализации этого пункта на место ожога накладывают повязку, пропитанную холодной водой, или принимают обезболивающее лекарство.
Внимание! Если повреждённая кожа покрылась волдырями, следует незамедлительно вызвать скорую помощь.